Un fluide est dans un « état supercritique » lorsqu’il est placé à une température supérieure à sa température critique et à une pression supérieure à sa pression critique. Au-dessus de ces conditions, il n’y a pas de frontière entre le liquide et le gaz, et de petites variations de température ou de pression peuvent entraîner des changements continus dans la densité du fluide, son pouvoir solvant et dans d’autres propriétés physiques.
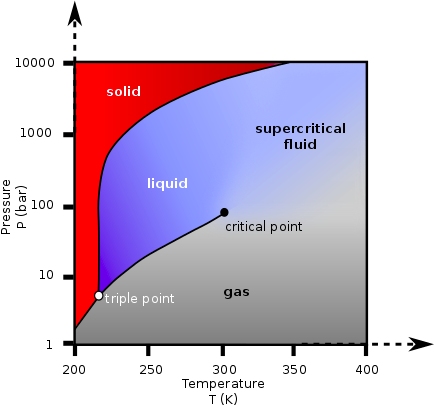
Les fluides supercritiques peuvent être placés dans des conditions où ils possèdent plusieurs propriétés intéressantes des liquides et des gaz. On peut par exemple se placer dans des conditions conduisant à des taux de transfert de masse très rapides, ce qui est très intéressant pour l’extraction ou la réaction, ou utiliser diffusion élevée et une faible viscosité conduisant à des applications sur des matériaux très poreux, l’imprégnation, la formation de nanoparticules etc…..
| Densité (kg/m3) | Viscosité (µPa.sec) | Diffusivité (mm2/s) | |
|---|---|---|---|
| Gaz | 1 | 10 | 1–10 |
| Fluide supercritique | 100–1000 | 50–100 | 0.01–0.1 |
| Liquide | 1000 | 500–1000 | 0.001 |
Compaisonde propriétés des gaz, fluides supercritiques et liquides
Les deux fluides supercritiques les plus utilisés sont le dioxyde de carbone (CO2) et l’eau (H2O). Les deux fluides sont facilement disponibles et peuvent être utilisés sous pression pour remplacer les solvants organiques ou en tant que procédés alternatifs respectueux de l’environnement.
| Solvant | Temperature critique (°C ) | Pression critique (Bar ) | Masse volumique citique (g/cm3 ) |
|---|---|---|---|
| Carbon dioxide (CO2) | 31.1 | 73,8 | 0.469 |
| Water (H2O) | 374 | 220 | 0.322 |
| Propane (C3H8) | 96,7 | 42,5 | 0.162 |
Les Fluides Supercritiques sur Wikipedia
Contactez nous pour en savoir plus sur les possibilités d’utilisation des fluides supercritiques